1. Tujuan
a. Mempelajari efek konsentrasi ggl sel
b. Mempelajari baterai
c. mempelajari korosi
2. Alat dan Bahan
a. Battery
Spesifikasi Battery:
Klasifikasi: Alkaline
Sistem Kimia: Zinc-Manganese Dioxide (Zn / MnO2)
Penunjukan: ANSI 1604A, IEC-6LF22 atau 6LR61
Tegangan Nominal: 9.0 volt
Suhu Operasi: -18 ° C hingga 55 ° C
Berat Khas: 45 gram
Volume Umum: 21 sentimeter kubik
Shelf Life: 5 tahun pada 21 ° C
Terminal: Jepretan Miniatur
Konfigurasi Battery:
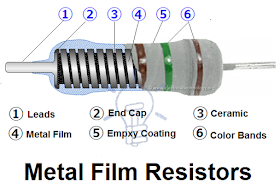
b. Resistor
Spesifikasi Resistor:
Konfigurasi Resistor:
C. Lamp Bulb
Spesifikasi Lamp Bulb :
· Watt: 10W
· Watt setara: 60 W pijar
· Tegangan: 40v / Tegangan Listrik
· Bentuk: A55 / GLS / Klasik
· Basis lampu sekrup: E27 / Edison
· Sudut Balok: 150 °
· Tidak dapat diredupkan
· Daya tahan: 15000 Jam
· CRI%: > 80%
· Keluaran Lumen: 806
· Warna: 3000K / 830 / Putih Hangat
Konfigurasi Lamp Bulb :
3. Dasar Teori
18.5 Efek Dari Konsentrasi GGL Sel
Sejauh ini kami telah berfokus pada reaksi redoks di mana reaktan dan produk berada
keadaan standar mereka, tetapi kondisi keadaan standar seringkali sulit, dan terkadang
tidak mungkin, untuk dipertahankan. Namun, ada hubungan matematis antara
ggl sel galvanik dan konsentrasi reaktan dan produk dalam redoks
reaksi dalam kondisi nonstandar. Persamaan ini diturunkan selanjutnya.
Persamaan Nernst
E = E° - (RT/nF) ln Q …… 18.7
dengan Q adalah hasil bagi reaksi (lihat Bagian 14.4). Pada 298 K, Persamaan (18,7) dapat ditulis ulang sebagai
E = E° - (0.0257 V/n ) ln Q …..18.8
atau, mengekspresikan Persamaan (18.8) menggunakan logaritma basis-10 dari Q:
E = E° - (0.0592 V/ n ) log Q
Selama pengoperasian sel galvanik, elektron mengalir dari anoda ke katoda,
menghasilkan pembentukan produk dan penurunan konsentrasi reaktan. Jadi, Q
meningkat, yang berarti E menurun. Akhirnya, sel mencapai keseimbangan. Di
kesetimbangan, tidak ada transfer elektron bersih, jadi E = 0 dan Q = K, di mana K adalah
konstanta kesetimbangan. Persamaan Nernst memungkinkan kita menghitung E sebagai fungsi reaktan dan konsentrasi produk dalam reaksi redoks.
Sel Konsentrasi
Karena potensial elektroda tergantung pada konsentrasi ion, maka memungkinkan untuk dibangun. sel galvanik dari dua setengah sel yang terdiri dari bahan yang sama tetapi ionnya berbeda konsentrasi. Sel semacam itu disebut sel konsentrasi.
18.6 Baterai
Baterai adalah sel galvanik, atau serangkaian sel galvanik gabungan, yang dapat digunakan
sebagai sumber arus listrik searah dengan tegangan konstan. Meskipun pengoperasian baterai pada prinsipnya mirip dengan sel galvanik yang dijelaskan dalam Bagian 18.2, sebuah baterai memiliki keuntungan karena bisa berdiri sendiri dan tidak memerlukan komponen tambahan seperti jembatan garam. Disini kita akan membahas beberapa jenis baterai yang digunakan secara luas.
Baterai Sel Kering
Baterai Merkuri
Baterai merkuri digunakan secara luas dalam obat-obatan dan industri elektronik lebih mahal daripada sel kering biasa. Berisi dalam silinder stainless steel, itu baterai merkuri terdiri dari anoda seng (digabung dengan merkuri) yang bersentuhan dengan elektrolit basa kuat yang mengandung seng oksida dan merkuri (II) oksida (Gambar 18.8). Baik katoda dan anoda direndam dalam larutan asam sulfat, yang bertindak sebagai elektrolit.
Baterai Penyimpanan Utama (The Lead Storage Battery)
Baterai penyimpanan timbal yang biasa digunakan di mobil terdiri dari enam sel yang identik bergabung bersama secara seri. Setiap sel memiliki anoda timbal dan katoda yang terbuat dari timbal dioksida (PbO2) dikemas dalam pelat logam (Gambar 18.9). Baik katoda dan anoda direndam dalam larutan asam sulfat, yang bertindak sebagai elektrolit.
Baterai Lithium-Ion
Gambar 18.10 menunjukkan diagram skema baterai lithium-ion. Anoda dibuat dari bahan berkarbon konduksi, biasanya grafit, yang memiliki ruang kecil di dalamnya struktur yang dapat menahan atom Li dan ion Li. Katoda terbuat dari oksida logam transisi seperti CoO2, yang juga dapat menahan ion Li1. Karena tinggi reaktivitas logam, elektrolit tak berair (pelarut organik ditambah garam terlarut) harus digunakan.
Sel Bahan Bakar (Fuel Cells)
Bahan bakar fosil adalah sumber energi utama, tetapi bahan bakar fosil diubah menjadi listrik energi adalah proses yang sangat tidak efisien.Untuk menghasilkan listrik, panas yang dihasilkan oleh reaksi pertama-tama digunakan untuk mengubah air menjadi uap, yang kemudian menggerakkan turbin yang menggerakkan generator. Sebagian besar dari energi yang dilepaskan dalam bentuk panas hilang ke lingkungan pada setiap langkah; bahkan pembangkit listrik yang paling efisien hanya mengubah sekitar 40 persen bahan kimia asli energi menjadi listrik.
Suatu daerah permukaan logam berfungsi sebagai anoda, dimana oksidasi terjadi:
Fe(s) → Fe2+ + 2e-
Elektron yang dilepaskan oleh besi mengurangi oksigen atmosfer menjadi air di katoda, yang merupakan wilayah lain dari permukaan logam yang sama:
O2(g) + 4H+(aq) + 4e- → 2H2O(l)
Reaksi redoks keseluruhan adalah
2Fe(s) + O2(g) + 4H+(aq) → 2Fe2+(aq) + 2H2O(l)
Perhatikan bahwa reaksi ini terjadi dalam media asam; ion H+ disuplai sebagian oleh reaksi karbon dioksida atmosfer dengan air untuk membentuk H2CO3.
Ion Fe2+ yang terbentuk di anoda selanjutnya dioksidasi oleh oksigen :
4Fe2+(aq) + O2(g) + (4 1 2x) H2O(l) → 2Fe2O3 . xH2O(s) + 8H+(aq)
Bentuk besi (III) oksida terhidrasi ini dikenal sebagai karat. Jumlah air yang terkait dengan oksida besi bervariasi, jadi kami menyatakan rumusnya sebagai Fe2O3 .xH2O. Gambar 18.14 menunjukkan mekanisme pembentukan karat. Sirkuit listrik adalah diselesaikan dengan migrasi elektron dan ion; inilah mengapa karat terjadi begitu cepat dalam air garam.
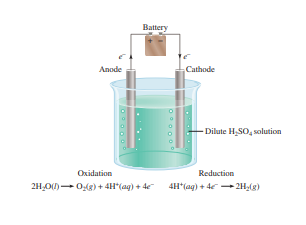
18.8 Elektrolisis
Berbeda dengan reaksi redoks spontan, yang menghasilkan konversi kimiawi energi menjadi energi listrik, elektrolisis adalah proses di mana energi listrik berada digunakan untuk menyebabkan reaksi kimia yang tidak spontan terjadi. Sel elektrolitik adalah alat untuk melakukan elektrolisis. Prinsip yang sama mendasari elektrolisis dan proses yang terjadi di sel galvanik. Di sini kita akan membahas tiga contoh elektrolisis berdasarkan prinsip-prinsip tersebut. Kemudian kita akan melihat aspek kuantitatif elektrolisis.
Elektrolisis Molten Sodium Chloride
Dalam keadaan cairnya, natrium klorida, suatu senyawa ionik, dapat dielektrolisis menjadi bentuk logam natrium dan klorin. Gambar 18.17 (a) adalah diagram sel Downs, yaitu digunakan untuk elektrolisis NaCl skala besar. Dalam NaCl cair, kation dan anion adalah ion Na+ dan Cl2, masing-masing. Gambar 18.17 (b) adalah diagram sederhana yang ditampilkan reaksi yang terjadi di elektroda. Sel elektrolitik berisi sepasang elektroda yang terhubung ke baterai. Baterai berfungsi sebagai "pompa elektron", penggerak elektron ke katoda, tempat reduksi terjadi, dan penarikan elektron dari anoda, dimana terjadi oksidasi. Reaksi di elektroda adalah Elektrolisis Air.
Air dalam gelas kimia dalam kondisi atmosfer (1 atm dan 25 ° C) tidak akan secara spontan terurai membentuk gas hidrogen dan oksigen karena energi bebas standar perubahan reaksi adalah besaran positif yang besar:
2H2O(l) → 2H2(g) + O2(g) ΔG° = 474,4 kJ / mol
Ini adalah yang paling rumit dari tiga contoh elektrolisis yang dibahas di sini
karena larutan natrium klorida berair mengandung beberapa spesies yang dapat teroksidasi dan direduksi.
(1) 2Cl-(aq) → Cl2(g0 + 2e-
(2) 2H2O(I) → O2(g) + 4H+(aq) + 4e-
Berdasarkan tabel 18.1, kita dapatkan :
O2(g) + 4H+(aq) + 4e- → 2H2O(l) E° = 1.23 V
(4) 2H2O(l) + 2e- → H2(g) + 2OH-(aq) E° = 20.83 V
(5) Na+(aq) + e- → Na(s) E° = 22.71 V
Reaksi (5) dikesampingkan karena memiliki potensi reduksi standar yang sangat negatif. Reaksi (3) lebih disukai daripada (4) di bawah kondisi keadaan standar. Pada pH 7 (apa adanya kasus untuk larutan NaCl), namun kemungkinannya sama. Kita biasanya menggunakan (4) untuk menggambarkan reaksi katoda karena konsentrasi ion H1 terlalu rendah (sekitar 1 3 1027 M) untuk membuat (3) pilihan yang masuk akal. Jadi, reaksi setengah sel dalam elektrolisis natrium klorida berair adalah Seperti yang ditunjukkan oleh reaksi keseluruhan, konsentrasi ion Cl2 menurun selama elektrolisis dan ion OH- meningkat. Oleh karena itu, selain H2 dan Cl2, produk samping NaOH yang berguna dapat diperoleh dengan menguapkan larutan berair di akhir elektrolisis. Ingatlah hal-hal berikut dari analisis elektrolisis kami: kemungkinan kation direduksi di katoda dan anion cenderung teroksidasi di anoda, dan dalam larutan air, air itu sendiri dapat dioksidasi dan / atau direduksi. Hasilnya tergantung pada sifat spesies lain yang ada. Contoh 18.8 berkaitan dengan elektrolisis larutan natrium sulfat (Na2SO4) berair.
4. Langkah-langkah
· Siapkan alat dan bahan
· Baca materi yang akan diringkas
· Lalu, ringkaslah dengan melihat yang penting dalam materi tersebut
· Lalu upload ke blogger
Tahap Rangkaian:
· Siapkan alat dan bahan
· Letakkan komponen sesuai gambar atau sesuai selera
· Lalu, sambungkan (+) battery ke resistor
· Lalu, sambungkan resistor ke lampu
· Lalu, sambungkan lampu ke (-)Battery
· Lalu pasang DC voltmeter secara paralel di lampu
5. Prinsip Kerja
ketika baterai terhubung dengan resistro maka tegangan yang mengalir pada lampu akan
lebih kecil daripada baterai yang tidak mengalir melalui resistor sehingga lampu yang membutuhkan tegangan 12 V kan hidup
6. Gambar Rangkaian
7. Video

















Tidak ada komentar:
Posting Komentar