Latihan / Example
1. Example 23.1
Example 6.7
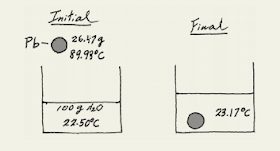
Pelet timbal (Pb) bermassa 26,47 g pada suhu 89,988C ditempatkan dalam tekanan konstan
kalorimeter kapasitas panas diabaikan yang berisi 100,0 mL air. Air
suhu naik dari 22.508C menjadi 23.178C. Berapa kalor jenis pelet timbal?
Strategi Sketsa situasi awal dan akhir adalah sebagai berikut:
Kita mengetahui massa air dan pelet timbal serta awal dan akhir
suhu. Dengan asumsi tidak ada panas yang hilang ke lingkungan, kita dapat menyamakan panas yang hilang
oleh pelet timbal ke panas yang diperoleh oleh air. Mengetahui kalor jenis air,
2Al(s) + Fe2O3(s) -> Al2O3(s) + 2Fe(l)
Hitung panas yang dilepaskan dalam kilojoule per gram Al yang direaksikan dengan Fe2O3. DH8f
untuk Fe (l) adalah 12,40 kJ / mol.
Strategi Entalpi reaksi adalah perbedaan antara jumlah entalpi
dari produk dan jumlah entalpi reaktan. Entalpi masing-masing
spesies (reaktan atau produk) diberikan oleh koefisien stoikiometri kali standar
entalpi pembentukan spesies.
Solusi Menggunakan nilai DH8f yang diberikan untuk Fe (l) dan nilai DH8f lainnya pada Lampiran 3 dan
Persamaan (6.18), kita tulis
¢H°rxn = [¢H°f(Al2O3) + 2¢H°f(Fe)] - [2¢H°f(Al) + ¢H°f(Fe2O3)]
= [(- 1669.8 kJ/mol) + 2(12.40 kJ/mol)] - [2(0) + (-822.2 kJ/mol)]
= -822.8 kJ/mol
Ini adalah jumlah panas yang dilepaskan untuk dua mol Al yang bereaksi. Kami menggunakan rasio berikut
-822.8 kJ/2 mol Al
untuk mengonversi ke kJ / g Al. Jadi, massa molar Al adalah 26,98 g
panas yang dilepaskan per gram Al
= -822.8 kJ/2 mol Al x 1 mol Al/26.98 g Al
=215.25 kJ/g
Periksa Apakah tanda negatif konsisten dengan sifat eksotermik reaksi? Sebagai
pemeriksaan cepat, kita melihat bahwa 2 mol Al beratnya sekitar 54 g dan mengeluarkan sekitar 823 kJ panas saat direaksikan dengan Fe2O3. Oleh karena itu, panas yang dilepaskan per gram Al yang direaksikan adalah sekitar 2830 kJ / 54 g atau 215,4 kJ / g. Latihan Latihan Benzene (C6H6) terbakar di udara untuk menghasilkan karbon dioksida dan cairan air. Hitung panas yang dilepaskan (dalam kilojoule) per gram senyawa yang direaksikan dengan oksigen. Entalpi pembentukan standar benzena adalah 49,04 kJ / mol.
2. Jika diketahui ΔHc°C = -393,5 kJ mol‾¹ , berapa kalor yang terjadi pada pembakaran 1 kg arang, jika dianggap bahwa arang mengandung 48% karbon dan Ar C = 12?
Pembahasan:
ΔHc°C = -393,5 kJ mol -1
massa C = 48/100 x 1000 gram
= 480 gram
Pada pembakaran 1 mol karbon dibebaskan kalor 393,5 kJ maka pada pembakaran 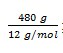 karbon dihasilkan kalor sebanyak:
karbon dihasilkan kalor sebanyak:
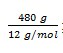 x 393,5 kJ/mol
x 393,5 kJ/mol
= 15.740 kJ
Tidak ada komentar:
Posting Komentar