Example/contoh
1. Bahan yang digunakan sebagai elektrode pada sel aki (accu) adalah …
a. Pt dan C
b. Zn dan C
c. Pb dan PbO2
d. Zn dan Cu
e. Cu dan PbO2
Jawaban : C
Pembahasan :
Aki merupakan sel yang banyak kita jumpai karena banyak digunakan pada sepeda motor maupun mobil. Aki temasuk sel sekunder, karena selain menghasilkan arus listrik, aki juga dapat diisi arus listrik kembali.
Secara sederhana Sesuai prinsip pada sel Volta, aki merupakan sel yang terdiri dari elektrode Pb sebagai anode dan PbO2 sebagai katode dengan elektrolit H2SO4.
2. Diketahui :
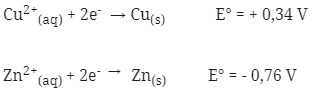
Bila kedua logam tersebut dipasangkan untuk membentuk sel volta, maka pernyataan berikut yang tidak benar adalah …
a. Elektrode Zn teroksidasi dan Elektrode Cu tereduksi
b. Elektrode Zn Sebagai Anode dan Cu sebagai Katode
c. Potensial sel yang dihasilkan adalah 1,10 volt
d. Notasi selnya : Zn(s)|Zn2+(aq)||Cu2+(aq)|Cu E°sel = 1,10 V
e. Dalam sistem sel volta tersebut elektron bergerak dari Cu menuju Zn
Jawaban : E
Pembahasan :
- Logam yang memiliki E° lebih kecil selalu merupakan Anode (mengalami oksidasi), berarti yang termasuk anode adalah Zn (E° = – 0,76 V) karena memiliki E° yang lebih kecil dari pada Cu (E° = + 0,34 V).
- Karena Zn sebagai Anode maka mengalami oksidasi sedangkan Cu sebagai Katode mengalami reduksi
- Notasi sel volta : Anode|ion||ion|katode
Maka :
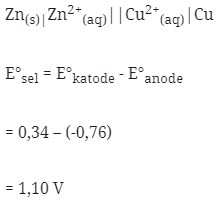
- Dalam sel volta elektron bergerak dari Anode ke Katode berarti dari Zn Menuju Cu
Kesimpulannya, pernyataan yang tidak benar adalah jawaban E
3. Logam yang tidak diperoleh dengan proses elektrolisis adalah …
a. Natrium
b. Aluminium
c. Magnesium
d. Kalsium
e. Merkuri
Jawaban : E
Pembahasan :
Logam-logam Natrium, Aluminium, Magnesium, dan Kalsium diperoleh dengan proses elektrolisis, sebab logam-logam ini tergolong reduktor kuat. Logam Merkuri (Raksa) adalah logam yang berwujud cair pada suhu kamar, tidak diendapkan di Katode.
Logam ini diperoleh dengan Pemanggangan HgS atau pemanasan HgO.
Reaksinya :
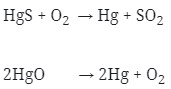
4. Pada elektrolisis larutan CuSO4 dengan elektrode Pt, dialirkan arus listrik 2 Ampere selama 965 detik (Ar Cu=63,5) maka banyaknya logam tembaga yang dihasilkan … mg
a. 317,5
b. 635,0
c. 952,5
d. 1.270
e. 1.905
Jawaban : B
Pembahasan :
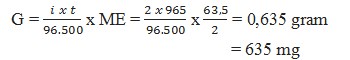
problem / kuis
bab 13
1. Kenaikan suhu akan mempercepat laju reaksi karena …
a. kenaikan suhu akan menyebabkan konsentrasi pereaksi meningkat
b. frekuensi tumbukan semakin tinggi
c. dalam reaksi kimia suhu berperan sebagai katalisator
d. kenaikan suhu akan mengakibatkan turunnya energi aktivasi
e. energi kinetik partikel-partikel yang bereaksi semakin tinggi
Jawaban : E
Pembahasan :
Kenaikan suhu akan mempercepat laju reaksi dikarenakan energi kinetik partikel-partikel yang bereaksi semakin tinggi. Apabila suhunya menurun maka energi kinetik partikel-partikel yang bereaksi semakin kecil.
2. Katalis alami yang digunakan dalam pembuatan asam sulfat adalah…
a. Nikel
b. V2O5
c. Fe
d. zeolit
e. Pt
Jawaban : B
Pembahasan :
V2O5 merupakan katalis alami yang digunakan untuk sintesis asam sulfat.
Pt juga merupakan katalis pembuatan asam sulfat tetapi perlu diproses kembali terlebih dahulu.
bab 14
1. Suatu sistem reaksi dalam keadaan setimbang bila…
a. Reaksi berlangsung dua arah pada waktu bersamaan
b. Reaksi berlangsung dalam dua arah dalam laju reaksi yang sama
c. Jumlah mol zat yang ada pada keadaan setimbang selalu sama
d. Masing-masing zat yang bereaksi sudah habis
e. Jumlah zat yang terbentuk dalam reaksi sama dengan pereaksi
Pembahasan:
Kesetimbangan dinamis yaitu proses bolak-balik dengan laju yang sama untuk kedua arah. Proses kesetimbangan dinamis ini dapat terjadi pula dalam suatu reaksi kimia.
Jawaban : B
2. Rumusan tetapan kesetimbangan untuk reaksi :

Pembahasan :
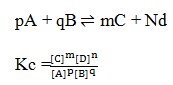
Hukum kesetimbangan yaitu bila suatu reaksi dalam keadaan setimbang, mak hasil kali konsentrasi zat-zat hasil reaksi dipangkatkan koefisiennya dibagi dengan hasil kali konsentrasi zat-zat pereaksi dipangkatkan koefisiennya akan mempunyai harga tetap. Jika reaksi itu dalam wujud solid dan liquid maka diabaikan.
Jawaban : E
bab 15
1. Larutan yang mempunyai pH lebih besar dari 7 adalah . . . .
a. Gula
b. Alkohol
c. Amoniak
d. Asam nitrat
e. Asam klorida
Pembahasan:
pH gula adalah netral(pH=7), sedangkan asam memiliki pH<7, pH alkohol adalah hampir netral 7,33. Amoniak merupakan basa, yang memiliki pH=12. Sehingga larutan yang mempunya pH lebih besar dari 7 adalah amoniak
Jawaban: C
3. Gas A,B, dan C masing-masing 0,4 mol, 0,6 ,mol, dan 0,2 mol dicampurkan dalam ruang tertutup dan terjadi reaksi kesetimbangan:
![]()
Pada saat setimbang 0,3 mol gas A telah bereaksi, maka gas B yang ada dalam keadaan setimbang adalah…
a. 0,5 mol
b. 0,4 mol
c. 0,3 mol
d. 0,2 mol
e. 0,1 mol
Pembahasan :
Dengan menggunakan perbandingan koefisien maka :
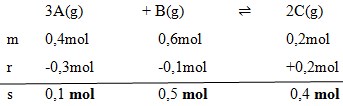
Jawaban : A
bab 16
1. Menurut teori asam-basa Bronsted-Lowry, asam didefinisikan sebagai zat yang . . . .
a. Meningkatkan [H+] bila dimasukkan kedalam H2O
b. Menurunkan [H+] bila dimaasukkan kedalam H2O
c. Meningkatkan [OH–] bila dimasukkan kedalam H2O
d. Menerima 1 H+ dari pasangan reaksinya
e. Memberi 1 H+ dari pasangan reaksinya
Pembahasan:
Teori asam Brosnted-Lowry:
- Asam: zat yang memberikan 1 H+ pada pasangan reaksinya.
- Basa: zat yang menerima 1 H+ dari pasangan reaksinya.
Jawaban: E
2. Kertas lakmus biru akan berubah menjadi merah, bila dimasukkan ke dalam larutan…
a. Kalium hidroksida
b. Natrium klorida
c. Barium sulfat
d. Asam klorida
e. Natrium nitrat
Pembahasan:
Kertas lakmus adalah kertas yang diberi suatu senyawa kimia sehingga akan menunjukkan warna yang berbeda setelah dimasukkan pada larutan asam maupun basa.
Warna kertas lakmus akan berubah sesuai dengan larutannya. Kertas lakmus biru akan berubah menjadi merah bila dimasukkan kedalam larutan asam klorida, karena asam klorida merupakan asam kuat.
Jawaban: D
bab 17
A. 60 kJ
B. 120 kJ
C. 280 kJ
D. 480 kJ
E. 660 kJ
Jawab : (A)
Penyelesaian :
V1 = 1,5 m3
T1 = 27oC = 300 K
T2 = 87oC = 360 K
P = 2 x 105 N/m2
Mencari V2 :
V2/T2 = V1/T1
V2 = ( V1/T1 ) x T2 = ( 1,5/300 ) x 360 = 1,8 m3
W = PΔV = 2 x 105(1,8 − 1,5) = 0,6 x 105 = 60 x 103 = 60 kJ
A. 120 J
B. 124 J
C. 135 J
D. 148 J
E. 200 J
Jawab : (E)
η = ( 1 − Tr / Tt ) x 100 %
Hilangkan saja 100% untuk memudahkan perhitungan :
η = ( 1 − 400/600) = 1/3
η = ( W / Q1 )
1/3 = W/600
W = 200 J
1. Nilai bilangan okidasi dari Cr didalam K2CrO4 adalah . . .
a. 4
b. 5
c. 6
d. 7
e. 8
Pembahasan :

Jawaban : C
2. Nilai bilangan okidasi dari S didalam Na2SO3 adalah . . .
a. 4
b. 5
c. 6
d. 7
e. 8
Pembahasan :
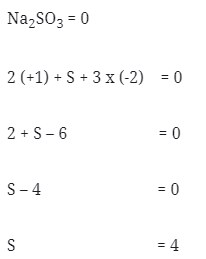
Jawaban : A



Tidak ada komentar:
Posting Komentar