A. LATIHAN
1. Persamaan termokimia yang termasuk perubahan entalpi pembentukan adalah...
PEMBAHASAN :
Entalpi pembentukan merupakan entalpi pemberntukan 1 mol senyawa (senyawa sebagai produk) dibentuk dari unsur - unsurnya yang stabil.
A. Benar, pemebntukan C2H5OH dibentuk dari unsur - unsur yang stabil
B. Salah, Karena dibentuk dari ion - ionnya
C. Salah, karena dibentuk dari senyawa
D Salah, karena dibentuk dari ion - ionnya
E. salah, karena dibentuk dari senyawa.
Jawaban : A
2.Jika diketahui ΔHc°C = -393,5 kJ mol‾¹ , berapa kalor yang terjadi pada pembakaran 1 kg arang, jika dianggap bahwa arang mengandung 48% karbon dan Ar C = 12?
a. 740 kJ
b. 470 kJ
c. 740 kJ
d. 470 kJ
e. 740 kJ
PEMBAHASAN :
ΔHc°C = -393,5 kJ mol -1
massa C = 48/100 x 1000 gram
= 480 gram
Pada pembakaran 1 mol karbon dibebaskan kalor 393,5 kJ maka pada pembakaran 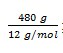 karbon dihasilkan kalor sebanyak:
karbon dihasilkan kalor sebanyak:
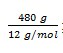 x 393,5 kJ/mol
x 393,5 kJ/mol
= 15.740 kJ
Jawaban : A
3. Dalam suatu calorimeter direaksikan 200 cm³ larutan NaOH 1 M dengan 200 cm³ larutan HCl 1 M, ternyata suhunya naik dari 29°C menjadi 36°C Kalor jensi larutan dianggap sama dengan kalor jenis air, yaitu 4,18 J/g°K dan massa jenis larutan dianggap 1 g/cm³.
Jika dianggap bahwa calorimeter tidak menyerap kalor, tentukanlah perubahan entalpi dari reaksi:
NaOH (aq) + HCl (aq) → NaCl (aq) + H2O (l)
a. +50,16 kJ
b. -50,16 kJ
c. +80,14 kJ
d. +11,704 kJ
e. -11,704 kJ
PEMBAHASAN :
qreaksi = -(qkalorimeter + qlarutan)
Oleh karena calorimeter tidak menyerap kalor, maka:
qreaksi = – qlarutan
volume = v NaOH + v HCl
= (200 + 200) mL
= 400 mL
massa larutan = volume larutan x rapatan larutan
= 400 mL x 1 gram/mL
= 400 gram
ΔT = (36 – 29 )°C
= 7°C
Atau ΔT = (36+273) – (29+273)
= 7 K
qlarutan = mlarutan x clarutan x ΔT
= 400 gram x 4,18 J/g K x 7 K
= 11.704 joule = 11,704 kJ
NaOH = HCl = 0,1L x 1 mol/L = 0,1 mol
Jadi pada reaksi antara 0,1 mol NaOH dengan 0,1 mol HCl terjadi perubahan kalor sebesar : qreaksi = – qlarutan
qreaksi = – 11,704 kJ
Maka, untuk setiap 1 mol NaOH yang bereaksi dengan 1 mol HCl akan terjadi perubahan kalor sebesar:
qreaksi = – 11,704 kJ/0,1 mol = – 11,704 kJ/mol
Perubahan kalor yang bertanda negative menunjukkan reaksi berlangsung secara eksoterm. Pada tekanan konstan, perubahan kalornya sama dengan perubahan entalpinya. Persamaan termokimianya:
NaOH (aq) + HCl (aq) → NaCl (aq) + H2O (l) ΔH= -11,704 kJ
Jawaban: E
4. Kegunaan Bom yang dibenamkan dalam calorimeter adalah ….
a. Untuk pendingin
b. Untuk pereda
c. Untuk melangsungkan reaksi pembakaran sampel
d. Untuk membakar rumah
e. Untuk memasak makanan
Pembahasan :
di dalam kalorimeter bom terdapat ruang khusus yang disebut Bom, dan diisi dengan gas oksigen pada tekanan tinggi. Bom yang dibenamkan dalam kalorimeter yang berirsi air digunakan untuk melangsungkan reaksi pembakaran sampel.
Jawaban : C
B. KUIS
chapter 1
- Massa sebuah elektron kira-kira 0,000.000.000.000.000.000.000.000.000.000.911 kg. Jika dituliskan dalm bentuk notasi ilmiah maka massa elektron dapat dituliskan sebagai….
- kg
- kg
- kg
- kg
- kg
Pembahasan :
Jawaban A hingga E semua benar jika dilihat dari nilainya. Tapi berdasarkan aturan yang berlaku, jawaban yang tepat adalah B karena nilai harus kurang dari 10 dan lebih dari satu.
Jawaban: B
2. berapa 26m adalah ... mm
a. 260 mm
b. 260000 mm
c. 26000 mm
d. 26 ^10 mm
e. 0,26 mm
Pembahasan :
26m = 26000 mm
Jawaban: C
chapter 2
1. Atom merupakan bola padat. Model atom tersebut dikemukakan oleh..
A. ThomsonB. Rutherford
C. Dalton
D. Bohr
B. 4 atom Fe, 2 atom S, 24 atom O
C. 2 atom Fe, 3 atom S, 12 atom O
D. 4 atom Fe, 6 atom S, 24 atom O
(diketahui Ar N = 14, C = 12, O = 16, H = 1)
A. 5 %
B. 40 %
C. 45 %
D. 80 %
E. 90 %
Jawaban: E
Pembahasan:
Mr CO(NH2)2 = Ar C + Ar O + 2xAr N + (4xAr H)
Mr CO(NH2)2 = 12 + 16 + 2x14 + (4x1)
Mr CO(NH2)2 = 60
A. XY
B. XY2
C. XY3
D. X2Y
E. X2Y2
Jawaban : D
Pembahasan :

chapter 4
1. Nilai bilangan okidasi dari Cr didalam K2CrO4 adalah . . .
a. 4
b. 5
c. 6
d. 7
e. 8
Pembahasan :

2. Reaksi Redoks :
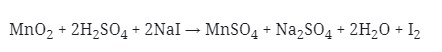
Yang berperan sebagai oksidator pada reaksi di atas adalah . . .
a. NaI
b. H2SO4
c. Mn2+
d. I–
e. MnO2
Pembahasan :
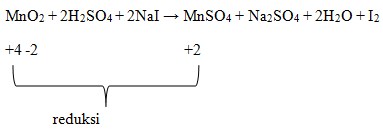
Diketahui bahwa oksidator yang mengalami reduksi atau penurunan biloks.
Dimana dilihat bahwa Mn pada MnO2 adalah +4.
Biloks Mn pad MnSO4 adalah +2.
Terjadi penurunan biloks, sehingga MnO2 menjadi oksidator.
Jawaban : E
chapter 5
Gas hasil reaksi tersebut pada V dan T tetap memberikan tekanan 6 atm. Jika kedua pereaksi habis bereaksi, tekanan total gas sebelum reaksi adalah .....
Pembahasan :
Secara stoikiometri pada reaksi yang setara, zat-zat berwujud gas pada V dan T tetap, tekanannya sebanding dengan koefisien atau jumlah zat-zat tersebut.
Karena pada saat akhir reaksi tidak terdapat sisa gas pereaksi, maka pada keadaan akhir itu hanya ada zat hasil reaksi saja.
Saat akhir terdapat 6 atm CH3OH, jadi pada saat bereaksi CH3OH juga 6 atm.
Karena koefisien CH3OH adalah 1, maka sebanding dengan itu maka tekanan untuk CO dan H2 juga dapat ditentukan.
Tekanan CO sebanding dengan tekanan CH3OH yaitu 6 atm. Tekanan H2 2 kali tekanan CH3OH yaitu 2×6 atm = 12 atm.
Jadi pada keadaan awak dibutuhkan CO 6 atm dan H2 12 atm. Total tekanan pereaksi sebelum bereaksi adalah (6 + 12) atm = 18 atm
Jawaban : C
2. Pada P, V, dan T yang sama, sejumlah gas X memiliki massa 2 kali massa gas CH4 (Ar N = 14, C = 12, O = 16, dan H = 1). Dari fakta tersebut dapat disimpulkan bahwa gas X adalah ....
(A) O2(B) C2H2
(C) C2H6
(D) CO
(E) N2
Bila P, V, dan T sama artinya n (jumlah zat) juga sama. Ingat persamaan P.V = n.R.T
Asumsikan terdapat 1 mol gas CH4 yang bermassa = {12+ (1×4)} g = 16 g.Massa setiap 1 mol gas X = 2 × massa CH4
Massa setiap 1 mol gas X = 2 × 16 g
Massa setiap 1 mol gas X = 32 g
Massa tiap mol gas yang tersedia:
O2 = (2×16) g = 32 g
C2H2 = (12×2) g +(1×2) g = 26 g
C2H6 = (12×2) g +(1×6) g = 30 g
CO = (12 +16) g = 28 g
N2 = (2×14) g = 28 g
Jawaban : A
A. 1, 2, 3
B. 0, 1, 2, 3
C. 1, 2, 3, 4,
D. 0, 1, 2, 3, 4
E. Tidak bergantung pada harga n
Pembahasan :
Jika n = 4, maka :
Harga l = 0, …..(n-1) = 0, 1, 2, 3
Jawaban : B
chapter 8
1. Perhatikan data afinitas elektron berikut!
| Unsur | Afinitas Elektron |
| X | 240 kJ.mol−1 |
| Y | −349 kJ.mol−1 |
Pernyataan yang tepat untuk kedua unsur tersebut dalam mencapai kestabilan adalah ….
A. ion X− lebih stabil daripada atom X
B. ion Y− lebih stabil daripada atom Y
C. Y lebih mudah melepas elektron daripada X
D. X lebih bersifat nonlogam daripada Y
E. X lebih mudah menarik elektron daripada Y
Pembahasan :
Afinitas elektron adalah besarnya energi yang dilepaskan oleh suatu atom ketika menangkap elektron (membentuk ion negatif). Unsur yang memiliki afinitas elektron bertanda negatif, mempunyai kecenderungan lebih besar dalam membentuk ion negatif.Berdasarkan keterangan di atas, unsur yang mempunyai afinitas elektron negatif, yaitu Y, bersifat:
- lebih mudah menangkap elektron
- lebih stabil membentuk Y−
- lebih bersifat nonlogam
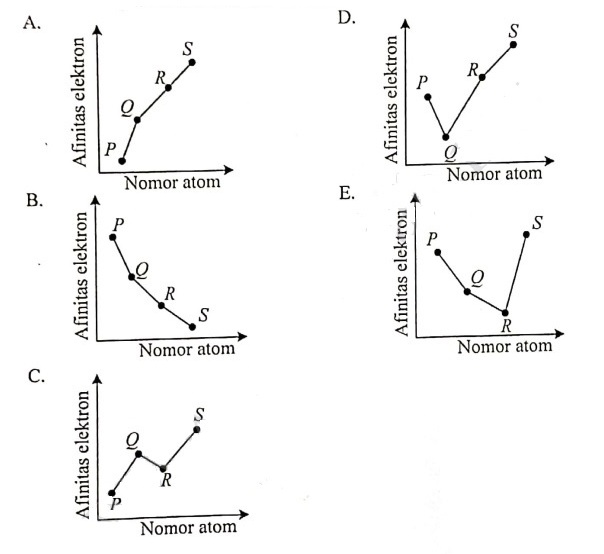
Jawaban: D
Pembahasan:
| Unsur | Nomor Atom | Golongan | Periode |
| P | 6 | IVA | 2 |
| Q | 7 | VA | 2 |
| R | 8 | VIA | 2 |
| S | 9 | VIIA | 2 |
Afinitas elektron, dalam satu periode dari kiri ke kanan cenderung semakin meningkat, kecuali pada golongan IIA dan VA. Sehingga grafik yang menggambarkan hubungan antara afinitas elektron dengan nomor atom keempat unsur tersebut adalah grafik D.

17B = 2, 8, 7 [valensi 7]
Unsur A mempunyai valensi 5 sehingga membutuhkan 3 elektron agar terpenuhi kaidah oktet. Sedangkan unsur B bervalensi 7 sehingga hanya membutuhkan 1 elektron.
Dengan demikian, senyawa yang terbentuk adalah AB3.

Jawaban: C
12X6 dan 1Y1
Bila unsur X dan Y berikatan, struktur Lewis molekul senyawa yang terbentuk adalah ….
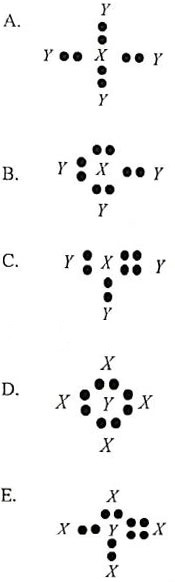
Jawaban: A
Pembahasan:
6X = 2, 4
1Y = 1
Itu artinya, apabila atom X berikatan dengan atom Y akan membentuk senyawa XY4. Struktur Lewis dari senyawa XY4 ditunjukkan seperti pada pilihan A.
Jawaban: A14N7, 32S16, dan 19F9
Berdasarkan data, tipe dan geometri molekul SF4 dan NF3 berturut-turut ditunjukkan oleh nomor ….
A. 2 dan 1
B. 3 dan 2
C. 3 dan 5
D. 4 dan 1
E. 5 dan 4
Jawaban: E
Pembahasan:
Konfigurasi elektron SF4
S = 2, 8, 6
F = 2, 7
- Jumlah pasangan elektron ikatan (PEI) SF4 = 4
- Jumlah pasangan elektron bebas (PEB) SF4 = 1
- Tipe molekul SF4 = AX4
Konfigurasi elektron NF3
N = 2, 5
F = 2, 7
- Jumlah pasangan elektron ikatan (PEI) SF4 = 3
- Jumlah pasangan elektron bebas (PEB) SF4 = 1
- Tipe molekul SF4 = AX3
Si = [Ne] 3s2 3p2
F = [He] 2s2 2p5
Jika kedua unsur tersebut membentuk senyawa, bentuk molekul yang terjadi sesuai aturan oktet adalah ….
A. linear
B. segitiga datar
C. tetrahedral
D. segitiga piramida
E. oktahedral
Si = [Ne] 3s2 3p2 (4 elektron valensi)
F = [He] 2s2 2p5 (7 elektron valensi)
Unsur Si mempunyai 4 elektron terluar. Agar tercapai kaidah oktet, keempatnya harus berikatan dengan F sehingga tidak terdapat elektron bebas. Sedangkan F hanya membutuhkan 1 elektron dari Si sehingga dibutuhkan 4 unsur F agar terbentuk senyawa SiF4.
- atom pusat : Si
- PEI : 4
- PEB : ½(4 − 4) = 0
- tipe molekul : AX4
- bentuk molekul : tetrahedral

Pernyataan yang benar tentang sifat benda sesuai gambar ditunjukkan oleh ….

Pembahasan:
Benda nomor I: Asap berwujud gas sehingga mempunyai sifat volume dan bentuk selalu berubah – ubah.
Benda nomor II: Air merupakan zat cair sehingga mempunyai sifat volume tetap dan bentuk berubah.
Benda nomor III: Kaca adalah zat padat memiliki sifat volume tetap dan bentuk tetap.
Jadi, pernyataan yang benar tentang sifat benda sesuai gambar ditunjukkan oleh pilihan C.
- Benda I: volume berubah, bentuk berubah
- Benda II: volume tetap, bentuk berubah
- Benda III: volume tetap, bentuk tetap
Jawaban: D
2. Perhatikan benda-benda pada gambar berikut!

Sifat ketiga benda pada gambar di atas yang benar adalah…

Pembahasan:
Benda nomor 1: Balok kayu termasuk zat pada memiliki sifat volume tetap dan bentuk tetap.
Benda nomor 2: Minyak goreng merupakan zat cair yang memiliki sifat volume tetap dan bentuk berubah – ubah sesuai wadahnya.
Benda nomor 3: Awan adalah benda yang termasuk zat gas yang memiliki sifat volume dan bentuk selalu berubah – ubah.
Jadi, pernyataan yang benar tentang sifat benda sesuai gambar ditunjukkan oleh pilihan C.
- Benda I: volume tetap, bentuk tetap
- Benda II: volume tetap, bentuk berubah
- Benda III: volume berubah, bentuk berubah
Jawaban: C



Jawaban: C









Tidak ada komentar:
Posting Komentar